(Practical aspects of EHV-1 and EHV-4 diagnostics
Summary. The authors summarise the pathogenesis, clinical findings and diagnosis of equine herpesvirus-1 and 4 infection, with special regard to new research data which can be applied for performing fast and specific diagnostic methods.
The most important herpesviruses of horses are EHV-1 and EHV-4, members of Alphaherpesvirinae subfamily. EHV-4 usually causes severe respiratory signs, while EHV-1 infection can cause serious economic losses through the abortion of pregnant mares and neurological disorders. The herpes-specific latency can also occur among infected horses, these animals serve as a reservoir of the virus.
The infection with EHV-1 or EHV-4 can be detected with indirect (antibodies raised against the virus) and direct (virus or DNA of the virus) diagnostic methods. When clinical signs occur, applicability of serological methods is limited; therefore the role of direct virus isolation, especially with molecular methods [polymerase chain reaction (PCR)] is increasing. A single nucleotide polymorphism (SNP) in ORF30 region of the EHV-1 genome is strongly associated with the neuropathogenic attributes of the virus strain. A new real-time PCR method is developed at the Virology Department of AO VDD which can help in distinguishing the neuropathogenic and non-neuropathogenic genotypes of EHV-1.)
A lovak herpeszvírusai közül a legnagyobb jelentőségű az 1-es (EHV-1) és a 4-es szerotípus (EHV-4). Az Alphaherpesvirinae alcsaládba tartozó kórokozók által okozott rhinopneumonitis, ill. a fertőzött kancák vetéléssel járó kórképe hazánkban is régóta ismert (6, 13), gazdasági jelentősége, a vakcinázások ellenére, még napjainkban is jelentős (17, 23, 24, 25). Érdekes, hogy az idegrendszeri forma hazánkban az elmúlt 40 évben mindössze 1 esetben fordult elő (Pálfi, személyes közlés). A hosszú évtizedeken át a lovak rhinopneumonitise vírusaként ismert EHV-1 vírustól a szövetspektrum, az egérpathogenitás és végül a genomok restrikciós enzimekkel végzett összehasonlító vizsgálatainak eredményei alapján 1981-ben különítették el az EHV-4 szerotípust (19, 20). A két szerotípus eltérő kórképekben fordul elő, ennek oka az EHV-1 és EHV-4 fertőzések eltérő kórfejlődésében keresendő.
Az EHV-1 a fertőzést követően a felső légutak nyálkahártyájának hámsejtjeiben szaporodik el, ezt követően eljut a regionális nyirokcsomókba, majd pedig, ún. sejthez kötött viraemia során, a fertőzött fehérvérsejtekkel az endometriumba, a magzatba és a központi idegrendszerbe. Az EHV-4-fertőzés alatt az esetek döntő többségében nem alakul ki a sejthez kötött viraemia. Vandekerckhove és mtsai vizsgálataiban három EHV-4 törzs közül csak egy volt képes fertőzni a mononukleáris leukocytákat, ami magyarázatot ad arra, hogy az EHV-4 törzsek miért okoznak ritkán viraemiát és emiatt vetélést (27).
Az EHV-1 vírus légzőszervi tüneteket, vetélést, az újszülött csikók megbetegedését, valamint idegrendszeri tünetekkel járó kórképeket idéz elő. Ezzel szemben az EHV-4 vírust az esetek döntő többségében légzőszervi tünetekkel járó kórképekből mutatták ki. A vírusok közvetlen vagy közvetett módon elsősorban légúti váladék útján terjednek, emellett vetéléskor a magzatvíz, a magzatburok és a magzat is nagy mennyiségű vírust tartalmaz. Welch és mtsai vizsgálatai igazolták, hogy a heveny fertőzés lezajlása után perzisztens fertőzés alakul ki (30). Ennek során a virális DNS a trigeminalis ganglionban, a légutak lymphoid szöveteiben és a perifériás lymphocytákban perzisztál és az immunitást hátrányosan befolyásoló tényezők (pl. immunszuppresszív gyógyszerek alkalmazása, betegségek, stresszhatások, vemhesség) hatására a fertőzés reaktiválódhat. A gyakran mozgatott és fokozott stressznek kitett, perzisztensen fertőzött állatok (főleg a versenylovak), a gyakori reaktiválódás miatt, mivel ez az állapot általában nem jár klinikai tünetekkel, jelentős szerepet játszhatnak a vírus terjesztésében (1, 16, 21, 24, 26, 30).
A kórokozók a rutindiagnosztikában vírusizolálással vagy polimeráz láncreakció (PCR) segítségével különíthetőek el (3, 4, 10, 23). Szerológiai elkülönítésük, az erős keresztreakció miatt, nehéz.
Az EHV-1 által okozott kórképek
A kancák EHV-1 okozta vetélésére jellemző, hogy az esetek döntő többségében a vemheség utolsó 4 hónapjában következik be, a fertőződést vagy a vírus reaktiválódását követően hónapok múlva. A fehérvérsejtekkel az endometriumba jutott, vírussal fertőzött endothelsejtek károsodása miatt érfalgyulladás, majd thrombusképződés indul meg, amelyet vetélés követ. A vetélt magzatok ép lábhólyaggal, nem önemésztetten jönnek világra. Amennyiben a kanca a vemhesség végén fertőződik, akkor a beteg vagy egészségesnek látszó, normál időben megszületett csikó a méhen belül kialakult tüdőgyulladás következtében bágyadt, nem szopik, és vírusos vagy baktériumos társfertőzések következtében néhány napon belül elhullik. Ebben az esetben a vírusos tüdőgyulladásra jellemző kép kórjelző értékű lehet. Ha a thrombusképződés csak kisfokú, az endometrium sérülése nem jár vetéléssel, ilyenkor akár egészséges csikó is születhet (1, 24).
A lovak 1-es típusú herpeszvírusának a kancák vetéléseiben játszott hazai szerepét már többször is vizsgálták. Szeredi és mtsai egy átfogó vizsgálatban, amelyben 93 vetélt magzatot és 8 ellés után elpusztult csikót vizsgáltak, vírusizolálással a minták 12,9%-ában, immunhisztokémiai vizsgálattal a minták 14,9%-ában mutatták ki a vírust (23). Hasonló eredményt hozott Hornyák és mtsai által végzett kutatás (10), amelyben ez az arány 10,5%-os volt, ill. Szeredi és mtsai 1998 és 2000 között elvégzett felmérő vizsgálatában a vetélés után beküldött izolátumok 16%-ában sikerült kimutatni az EHV-1 vírust (25). Így kijelenthető, hogy a lovak fertőző eredetű vetéléseinek kiváltó okai között a kórokozó jelentősége nem csökkent.
Az EHV-1-fertőzés után kialakuló kórképek közül nemcsak a vetélés okozhat gazdasági károkat egy ménesben. Az EHV-1 vírus bizonyos esetekben idegrendszeri tüneteket válthat ki, elsősorban koordinálatlan mozgást, izomgyengeséget, vizeletcsepegést lehet megfigyelni. Jellemző a hátulsó lábak gyengesége, rogyadozása, a hátulsó lábak kitámasztása, esetenként kutyaszerű ülés (1, 16). Az idegrendszeri tünetek, ellentétben az Alphaherpesvirinae alcsalád más, neuropatogén tagjaival, amelyek célpontjai az idegsejtek, szintén a vírus által megtámadott endothelsejtek sérüléseire vezethetők vissza, a szövettani vizsgálat során diffúz, multifokális myeloencephalopathia, érgyulladás, ill. thrombosis és thromboischaemiás necrosis figyelhető meg az agy- és gerincvelőben (5). A központi idegrendszer károsodásának mértékétől függően különböző súlyosságú tünetek alakulhatnak ki, az enyhe, csak mozgatáskor észlelhető mozgászavartól az elfekvésig. Jellemző hogy a klinikai tünetek végső stádiuma 48 órán belül kialakul. A gyógykezelés a klinikai tünetek enyhítésére irányul, a betegség lefolyása után, a súlyosságtól függően, mozgászavarok maradhatnak vissza (6).
A betegség megelőzését a perzisztensen fertőzött állatok nehezítik meg, ugyanis az állományban cirkuláló vírus az idegrendszeri zavarok megjelenése előtt csak kevés állatnál okoz klinikai tüneteket, és ezek is főleg láz és enyhe légzőszervi elváltozások, amelyek nem feltétlenül utalnak az EHV-1-fertőzésre. A megelőzést gátolja továbbá az is, hogy az EHV-1 elleni védekezésre használt vakcinák, a fertőződést és a vírus idegrendszerbe való eljutását nem akadályozzák meg, csak a már fertőzött állatok vírusürítését mérséklik (16).
Kórjelző lehet a klinikai tünetek megjelenése után vett cerebrospinalis folyadék emelkedett fehérjeszintje, ill. a vírus kimutatható az idegrendszeri tüneteket mutató, lázas állatokból vett orrtamponokból vagy alvadásban gátolt vérmintákból. Van Maanen és mtsai egy lovas iskolában lezajlott EHV-1-járvány tapasztalatai alapján azt a következtetést vonták le, hogy a klinikai tünetek megjelenésekor vett vérből elvégzett szerológiai vizsgálat diagnosztikai értékű lehet. A 41 lóból 20-nak volt enyhébb vagy súlyosabb idegrendszeri tünete, emellett 28 állat szerológiai vizsgálata során tapasztaltak specifikus titeremelkedést. 12 ló esetében már a savópár először vett mintáiban is nagy volt az EHV-1 ellen termelt ellenanyagok szintje, ami friss fertőzésre utalt. Ezért a vetéléses kórformával ellentétben, ebben az esetben a szerológiai vizsgálat diagnosztikai értékű (28).
A csikókban előforduló légzőszervi tünetek okozója nemcsak az EHV-1, hanem az EHV-4 vírus is lehet. A klinikai tünetek mindkét típusnál nagyon hasonlóak, főleg felső légúti tüneteket okoznak, többek között orr- és garatgyulladást, továbbá tracheobronchitist, de EHV-1-fertőzés esetén előfordulhatnak elváltozások az alsóbb légutakban is, amelyek a szopós csikóknál légzési zavart (tachypnoe, dyspnoe) okozhatnak. A légzési nehézségek következtében a csikók a szopás zavarai miatt lesoványodhatnak. A tünetek lefolyását nagyban befolyásolja az állatok kora, immunológiai állapota és az adott vírustörzs virulenciája. A legsúlyosabb tünetek azokban a csikókban alakulnak ki, amelyek először találkoznak a vírussal. Idősebb állatok esetén és a látens fertőzés aktiválódásakor a légúti tünetek nagyon enyhék, esetleg teljesen hiányozhatnak (1, 16). A légzőszervi tünetek önmagukban is okozhatnak súlyos problémákat, azonban egy herpeszvírusos légúti fertőzés alapul szolgálhat az állat másodlagos bakteriális felülfertőződéséhez (pl. Streptococcus zooepidemicus, Rhodococcus equi).
Az idegrendszeri kórformán kívül a légzőszervi forma az, ahol a szerológiai vizsgálatok kórjelző értékűek lehetnek. A savópár első mintáját a klinikai tünetek megjelenése után 2–3 napon belül kell levenni, a másodikat 3 hét múlva. A négyszeres vagy nagyobb titeremelkedés már specifikusnak számít, viszont az eredmények elbírálásakor figyelembe kell venni a korábbi vakcinázásokat is. Az 1:512 vagy nagyobb VN-titerek friss fertőződésre, nem pedig vakcinázásra utalnak (2).
Védekezés a ló 1-es és 4-es típusú herpeszvírusai ellen
A lóállományok EHV-1- és EHV-4-fertőzéstől való mentesítése a vírusok nagymértékű elterjedtsége, a látencia, valamint az állatok nagy értéke miatt jelenleg nem jöhet szóba. A védekezés során a megbetegedések megelőzése a leghatékonyabb eszköz, aminek a két, azonos fontosságú eleme a megfelelő tartástechnológia és a vakcinázás.
Az EHV-1 és EHV-4 okozta felső légúti megbetegedések elleni védekezés a csikók megszületése után, a kolosztrum kiszopásával kezdődik. A kolosztrális ellenanyagok felezési ideje 26 nap, a csikó a fertőzéssel szemben teljesen védtelenné általában 5–6 hónapos korában válik. A csikók vakcinázását úgy kell tervezni, hogy a legnagyobb immunitás a választási stressz idejére alakuljon ki. Ezt követően az oltásokat általában 6 havonta kell megismételni. A vakcinázások révén a csikók fertőződése esetén mind a vírusürítés mértékét, mind pedig időtartamát csökkenteni lehet. Ezzel állományszinten csökkenteni lehet a fertőzöttség mértékét, és így nagyobb esély kínálkozik a fertőzési lánc megszakítására vagy legalábbis korlátozására. A kancákat mindenképpen szükséges vakcinázni, bivalens, elölt ágenst tartalmazó vakcinával, kétszer egymás után, a fedeztetés előtt, majd az 5. és a 7. esetleg a 9. hónapban is. A vakcinák adta védettség a nagy mennyiségű vírussal való fertőződést ugyan nem tudja megakadályozni, de egyes esetekben meg tudja gátolni a klinikai tünetek kialakulását és csökkentheti a vetélések számát. A vakcinázott állatok, ha fertőződnek, lényegesen rövidebb ideig és kevesebb vírust ürítenek, mint a nem vakcinázott társaik. A vakcinázás tehát növeli az állományszintű védettséget és csökkenti a vírus terjedését.
A védekezés másik hatékony eszköze a megfelelő tartástechnológia alkalmazása. Ennek során törekedni kell a minél kisebb, állandó létszámú csoportok kialakítására, életkor, hasznosítás és ivar szerint. Az állatmozgásokat szabályozni kell, lehetőség szerint karantén rendszert kell alkalmazni. Fontos, hogy a kancacsoportokat még a vemhesítés előtt alakítsák ki, a vemhes kancákat, ill. azok csoportjait leellésükig izoláltan kell tartani. A fertőzés behurcolása szempontjából a legnagyobb veszélyt mindig idegen állatok bevitele jelenti. Ezért ezeket az állatokat az állományba való beállítás előtt legalább 21 napig elkülönítve kell tartani, megfigyelni, és az azonos immunológiai állapot kialakítása céljából esetleg vakcinázni kell. Az állományba visszatérő lovak esetén is javasolt a 21 napos elkülönítés és megfigyelés. Csökkenteni kell az állatokat ért stresszhatásokat, így a zsúfoltságot, a parazitás fertőzéseket, a hosszú szállítást és a csoportok keverését.
Az EHV-1 és EHV-4 vírusok okozta fertőzések diagnosztikája
A tünetek csak utalnak a betegségre, a biztos kórjelzés azonban a vírus, ill. a fertőzést követően megjelenő ellenanyagok kimutatásával lehetséges. A szerológiai vizsgálattal arra kapható válasz, hogy a vizsgált ló vérsavójában megtalálhatóak-e az EHV-1 ellen termelt ellenanyagok. A fertőződésre adott immunválasz humorális (a szisztémásan termelődött IgM, IgG és a lokálisan, a nyálkahártyákon megjelenő IgA típusú ellenanyagok) vagy celluláris lehet.
A vérsavóban megjelenő ellenanyagok ELISA-val és/vagy vírusneutralizációs próbával mutathatók ki. A heveny fertőzés kimutatására a savópárvizsgálat a legalkalmasabb, ebben az esetben a tünetek jelentkezésekor, majd 2–3 hét múlva vett vérmintát kell az intézetbe küldeni. A legalább 4-szeres titeremelkedés tekinthető kórjelzőnek. A kancák vetélése és a vírus reaktiválódása után megjelenő klinikai tünetek észlelésekor a savópárok vizsgálata nem kórjelző értékű, hiszen a primer vírusfertőzésre adott immunválasz már hónapokkal a tünetek megjelenése előtt lezajlott. Ezért ezekben az esetekben a savópárok titervizsgálata során már nem tapasztalható specifikus titeremelkedés (1).
A szerológiai vizsgálat során gondot okozhat a ló herpeszvírus 1-es és 4-es típusának szerológiai keresztreakciója. A két vírus ellen termelődött ellenanyag elkülöníthető párhuzamosan végzett vírusneutralizációval, ugyanis az adott vírussal történt heveny fertőzés során termelődött ellenanyagok általában jóval nagyobb mennyiségben vannak jelen, mint a keresztreagáló vírussal szembeniek. Ez azokban a laboratóriumokban jelenthet gondot, ahol nem rendelkeznek ló eredetű szövettenyészettel (pl. ED) vagy nincs vírusneutralizációra használható EHV-4 vírusuk. Léteznek ma már ELISA-tesztek, amelyek kifejezetten a két típus ellen termelődött ellenanyagok elkülönítésére szolgálnak.
A vetélések esetén a kórbonctani és a kórszövettani vizsgálat felkeltheti az EHV gyanúját. Az EHV-1 okozta vetélés esetén jellegzetesnek tartják a vetélt magzatok májában a szürkésfehér, miliaris elhalásos gócokat és a szomszédságukban lévő többé-kevésbé ép májsejtekben a sejtmagzárványok jelenlétét (18). A kórszövettani elváltozások vizsgálata során megállapították, hogy a 6 hónaposnál idősebb magzatok esetében általában már a mesenchymalis szövetek produktív jellegű elváltozásai találhatók (6). Kapp vizsgálatai alapján, a 6 hónaposnál fiatalabb, vetélt magzatok májában ezzel szemben az exsudativ elváltozások, a parenchymasejtek károsodása és a sejtmagzárványok jelenléte állnak előtérben (11).
Az EHV-1 és EHV-4 vírus kimutatását a kórképeknek megfelelően orr-garatváladékból, vetélt magzat szerveiből (lép, máj, tüdő és nyirokcsomók), magzatburokból, elhullott ló esetében lép-, máj-, tüdő- és agy-gerincvelő-mintákból, továbbá EDTA-t tartalmazó, alvadásban gátolt vérmintákból izolált fehérvérsejtekből kísérelhetjük meg. Fontos, hogy a váladékmintákat a klinikai tünetek megjelenését követő 48 órán belül vegyük.
A jellemző klinikai tünetek vagy a kórbonctani elváltozások megjelenése után vett mintákból a vírus kimutatására számos módszer használható. Az utóbbi évtizedekben új módszerek is megjelentek, ezek érzékenysége és gyorsasága megkönnyítette a vírus által okozott megbetegedések megállapítását. A vírus izolálására leginkább a beteg állatokból levett orrtamponok, ill. a vetélt vagy ellés után elpusztult csikók tüdeje (10), mája, lépe a legalkalmasabb. Idegrendszeri tünetek esetén a beküldés során mellékelni kell a központi idegrendszerből származó (agy- és gerincvelő-) mintákat is.
Sokáig az EHV-1 és EHV-4 azonosításának legfőbb módszere a beküldött minták különböző egyrétegű sejttenyészetekre (pl. ED, RK-13) oltása volt. Ha a mintákban jelen volt a kórokozó, a sejttenyészeteken 2–4 napon belül látható a vírusokra jellemző cytopathogen (CPE) hatás, a plakkszerűen formálódó, majd a sejttenyészetben gyorsan elterjedő syntitiumok megjelenése. A két típus között alapvető különbséget jelent, hogy míg az 1-es típus el tud szaporodni a nem ló eredetű szöveteken is (pl. az RK-13 nyúlveseszöveten), addig az EHV-4 csak lóból származó szövettenyészeteken (pl. ED-szövet) képes növekedni. Ez a tulajdonság fontos a két kórokozó elkülönítésében. A módszert ma is rutinszerűen alkalmazzák, viszont a negatív eredményt csak a második passzázs után lehet kimondani, ezért viszonylag hosszú ideig tart.
A kórokozók kimutatására (elsősorban az EHV-1) jól használhatók a kórszövettani módszerek. Az elpusztult állatokból beküldött szervek szövettani vizsgálata során a vírusra jellemző elváltozásokat kell keresni. A vírussal fertőzött állatok légútjainak epitheliumában, ill. a májban megjelenhetnek a vírusra jellemző, eosinophilen festődő, sejtmagzárványok. Jóval pontosabb az eredmény, ha a kórszövettan kiegészül immunhisztokémiai vizsgálattal is. Ebben az esetben nemcsak a jellemző szövettani elváltozások láthatók, amelyek csak közvetett módon utalnak a vírus jelenlétére, hanem a kórokozó közvetlenül is kimutatható (22, 23). Gyors eredményt ad a vírus közvetlen kimutatása fluoreszcenciával is. Ebben az esetben az elhullott állatokból származó szervekből kriosztáttal készül fagyasztott metszet, ami acetonos fixálás és konjugálás után vizsgálható. A módszer egyetlen hátránya, hogy a konjugátum kereszt reagál az EHV-4 vírus antigénjével is, így a tüneteket kiváltó herpeszvírus azonosításához további vizsgálatok szükségesek (8).
A vírusfertőzés modellezésére, pathogenitási vizsgálatokra, vakcinák hatékonyságának kipróbálására alkalmazható modellállat a laboregér. Az intranasalisan fertőzött egerekben megjelenő klinikai tünetek nagyon hasonlóak a lóban megjelenőkéhez (légzőszervi tünetek, vetélés), az egerek testtömeg-csökkenésének mértéke összefüggést mutat a vizsgált EHV-1 törzsek pathogenitásával (pathogenitási index). Az egyetlen különbség a betegség lefolyásában a ló és az egér között az, hogy az egerek között közvetlen érintkezés útján nem tud terjedni a fertőzés. A módszer bonyolult, drága és túl hosszú lefolyású ahhoz, hogy rutindiagnosztikára használható legyen, ezért ma már ritkán használják (15, 29).
A polimeráz láncreakció (PCR) a kórokozók nukleinsavának kimutatására szolgál. Az EHV-1 genomja viszonylag nagyméretű, kb. 150 000 bázispárból álló, dupla szálú DNS-molekula. A rutindiagnosztikában használt PCR-módszerek esetében egy olyan génrégiót sokszoroznak meg, ami kevés változatosságot mutat, így a különböző törzseket, amelyek genomja bizonyos szakaszokon eltérő lehet, ugyanolyan eséllyel mutatja ki. Ilyen, konzervatívnak tekinthető régiókat találtak a timidin-kináz génen, és a különböző glycoproteineket kódoló géneken (pl. glycoprotein G, C, H) (3, 4, 10). Az EHV-1 és EHV-4 elkülönítésére is létezik PCR-módszer, ennek a célrégiója a már említett timidin-kináz gén. A módszer lényege egy olyan PCR-reakció, amelyben nem két primert használnak, mint egy hagyományos PCR-nél, hanem ötöt, így azok a két különböző típus eltérő szekvenciáihoz is kötődni tudnak (multiplex-PCR). A különböző helyekre tapadó primerek azt eredményezik, hogy az EHV-1 és EHV-4 esetén különböző hosszúságú DNS-termékek keletkeznek, így a két típus a gélelektroforézis során jól elkülöníthető (3). A módszer tehát jóval gyorsabb elkülönítést tesz lehetővé, mint a legalább két passzázst használó vírusizolálás, és a PCR-módszer érzékenysége legalább olyan jó, továbbá rossz minőségű minták esetén még jobb is, mint a vírusizolálásé.
A real-time PCR-eljárások annyiban különböznek a hagyományos PCR-módszerektől, hogy vagy egy speciális festék épül be a keletkező specifikus DNS-termék két szála közé (pl. SYBRGREEN), vagy egy fluoreszcens festékkel jelölt probe (pl. Taqman-probe) kapcsolódik az egyre nagyobb mennyiségben keletkező specifikus termékekre (4). Az adott hullámhosszon gerjeszthető festékmolekulák által kibocsátott fluoreszcencia érzékelhető, és az eredmények értékeléséből következtethetünk arra, hogy az eredeti mintánkban milyen mennyiségben volt jelen a virális DNS. A módszer nagy előnye a hagyományos PCR-eljárásokhoz képest, hogy a folyamat a real-time PCR-géphez kapcsolt számítógép képernyőjén nyomon követhető, az eredmény elbírálásához nincs szükség gélelektroforézisre. A másik nagy előnye, hogy ha az eljárás során pozitív kontrollként ismert mennyiségű vírusnukleinsavat használnak, akkor ehhez viszonyítva arra is lehet következtetni, hogy az eredeti minta az adott nukleinsavból mennyit tartalmazott. Tehát a real-time PCR nemcsak kvalitatív, hanem kvantitatív vizsgálatra is alkalmas lehet.
Új módszer a neuropatogén és nem neuropatogén EHV-1 törzsek elkülönítésére
Két EHV-1 törzs teljes genomjának összehasonlítása során szignifikáns összefüggést találtak egy, az ORF30-as régióban előforduló pontmutáció, ill. az adott EHV-1 törzs neuropatogén tulajdonságai között (14). Az adott régió kódolja a vírus DNS-polimerázának katalitikus alegységét, az itt előforduló pontmutáció aminosav-változást okoz a 752-es pozícióban, ez úgy tűnik, több ponton is befolyásolni tudja a vírus neuropatogén tulajdonságait. A kis patogenitású törzsek esetén a viraemia során kevesebb a keringésben található vírusok száma. Az eltérő genotípushoz tartozó EHV-1 törzsek esetén eltérés tapasztalható abban is, hogy mely lymphocyták az elsődleges célpontok a vírusfertőzés során. A neuropatogén törzsek elsősorban a CD4+ T-lymphocytákat támadják meg, ezek a sejtek fontos szerepet játszanak a látens fázis kialakulásában, ill. az EHV-1 -fertőzés klinikai lefolyása során. A két különböző genotípusba tartozó törzsek esetén a vírusra adott immunválaszban is találtak különbségeket, a nagyobb patogenitású törzsekkel fertőzött állatoknál általában hosszabb a vírusürítési fázis, így a fertőzés gyorsabban tud terjedni a fogékony állatok között (7).
Az említett pontmutáció kimutatására különböző módszerek vannak, az adott szakasz nukleotidsorrendjét meg lehet határozni szekvenálással, restrikciós fragmenthossz-polimorfizmus analízissel (RFLP), ill. allélspecifikus Taqman-probe-okkal végrehajtott real-time PCR-módszerrel (14). Az MgSZH-ÁDI Emlős Virológiai Laboratóriumban egy másik elven alapuló, gyors és egyszerű módszert fejlesztettünk ki a törzsek elkülönítésére, ami egy fluoreszcens festékkel jelzett primer és a probe közötti energiaátvitelen alapul (primer-probe energy transfer − PriProET) (12). Ezzel a módszerrel egy lépésben, néhány óra alatt meg lehet állapítani, hogy az előzőleg már biztosan EHV-1-ként azonosított vírus a neuropatogén vagy a nem neuropatogén genotípusba tartozik-e. A neuropatogénitás genetikai markerének hiánya sem jelenti feltétlenül azt, hogy az adott törzs nem képes idegrendszeri tüneteket okozni, hiszen volt már példa arra, hogy a nem neuropatogén csoportba tartozó vírus okozott idegrendszeri tüneteket (9).
Eddig nem volt adatunk arról, hogy Magyarországon előfordul-e az EHV-1 neuropatogén genotípusa. A két típus elkülönítésére kifejlesztett módszer (12) segítségével megvizsgáltunk 35 EHV-1 törzset, amit 1977 és 2008 között küldtek be az MgSZH-ÁDI budapesti intézetébe, ill. akkor még Állat-egészségügyi Intézetbe. A minták vetélt magzatokból származtak, elsősorban lép, máj és magzatburok. Egyedül egy esetben szerepelt a kórelőzményben, hogy az állományban, a vetélés mellett, megjelentek az idegrendszeri tünetek is. A vizsgálati eredmények alapján a 35 törzsből összesen 5 izolátum (14,3%) tartozott a neuropatogén genotípusba, a többi a nem neuropatogén változatot hordozta. A kórelőzmény alapján idegrendszeri tüneteket okozó vírustörzs egyike volt az 5 neuropatogén törzsnek, ebben az esetben tehát igazolódott a marker jelentősége.
Következtetések
A külföldi és hazai szakirodalom alapján is látható, hogy a lovak herpeszvírusainak jelentőségét (elsősorban az EHV-1-ét) nem szabad alábecsülni akkor sem, ha egy állományban vakcinázás folyik. Egy értékes csikó elvetélése, ill. egy versenyző vagy tenyészállat idegrendszeri elváltozásai nagy gazdasági kárral járhatnak. A fertőzés és a klinikai tünetek elkerülése érdekében tisztában kell lenni a betegség járványtanával és a herpeszvírusokra jellemző speciális tulajdonságokkal.
Az MgSZH-ÁDI-ba EHV-1-vizsgálatára beküldött klinikai minták kis száma azt sugallja, hogy a vírus által okozott fertőzések száma csekély, ezt a képet azonban a lópraxisban dolgozó kollégák beszámolói cáfolják. A lótartás egyre növekvő költségei mellett a diagnosztikai vizsgálatok árai is további terhet jelentenek, de az alapos diagnózis hozzásegítheti a tulajdonost és az állatorvost is, hogy elkerüljék az állományban a vírus reaktiválódását. A táblázatban a budapesti intézetbe víruskimutatásra beküldött minták száma látható évenkénti bontásban, 2006 és 2010 között. Az intézetben két vizsgálatot használtunk a rutindiagnosztikában az EHV-1 kimutatására, az egyik a vírusizolálás, a másik az immunhisztokémia. A két módszer érzékenysége közel azonos, azonban élő állatokból (pl. orrtamponokból) vírusizolálással lehet a kórokozót kimutatni.
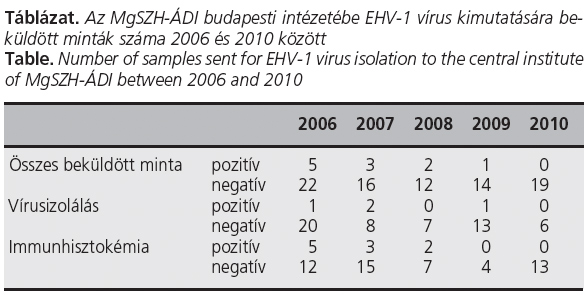
Látható, hogy a beküldött minták száma csak 2006-ban haladta meg a 20-at, azóta minden évben alatta maradt. A pozitív minták száma is csökkent, sőt 2010-ben nem volt egy sem, viszont nehezen hihető, hogy a vírus teljesen eltűnt volna az országból (Időközben 2011-ben egy állományon belül jelentkező vetélési hullámból, három magzatból is izoláltuk az EHV-1 vírusát.) Sajnos statisztikai összehasonlításra és az EHV-1 magyarországi előfordulására vonatkozó messzemenő következtetésekre a kimutatás nem használható, ugyanis a lovak vetéléssel járó eseteinek csak egy részéből kerül be minta intézeti vizsgálatra. A beküldött minták száma azért nem egyezik meg minden esetben a vírusizolálások és az immunhisztokémiai vizsgálatok számának az összegével, mert voltak minták, amelyeket mindkét módszerrel megvizsgáltunk. A pozitív minták számának különbségét is az okozza, hogy a később pozitívnak bizonyult mintákat nem minden esetben vizsgálták meg mindkét módszerrel.
Az EHV-1 elleni védekezés elsősorban azon múlik, hogy ismerjük-e a ló vagy az adott lóállomány EHV-1 státusát. A rendszeres vakcinázás mellett, ha a kancák mozgatását és csoportosítását a járványtani szempontok figyelembevételével végezzük, még a látensen fertőzött állatok esetén is minimálisra csökkenthető vagy megszüntethető a vírusürítés, és ezzel együtt a klinikai tünetek kialakulása is (26).
Az immunológiai státus ellenőrzése, ill. a gyanús esetek kivizsgálása a tartástechnológia két fontos eleme, aminek nagy jelentősége van abban, hogy fel tudjuk mérni azt, hogy egy adott állományban mekkora esélye van, hogy az EHV-1- vagy EHV-4-fertőzés klinikai tüneteinek megjelenésére. A fertőzött állományokban az állatok klinikai tüneteket kiváltó újrafertőződésének vagy a vírus reaktiválódásának esélye a gondos állománymenedzsmenttel és a rendszeres vakcinázással minimálisra csökkenthető.



